Nguyễn Linh Chi1,2, Ngô Thị Tường Châu2, Nguyễn Đình Tảo1, Nguyễn Ngọc Diệp3
1Bệnh viện Đa khoa 16A Hà Đông
2Đại học Khoa học Tự nhiên, Đại học Quốc gia Hà Nội
3Học viện Quân Y
Chịu trách nhiệm chính: Nguyễn Linh Chi
Email: linhchi148@gmail.com
Ngày nhận bài: 25/7/2022
Ngày phản biện khoa học: 10/08/2022
Ngày duyệt bài: 29/08/2022
TÓM TẮT
SUMMARY
COMPARISON THE IMPACTS OF CULTURE MEDIA AND DIFFERENT OXYGEN CONCENTRATION TO CHROMOSOMAL A BNORMALITIES OF EMBRYOS
Objective: Evaluating the chromosomal abnormalities of embryos when cultured at different oxygen concentrations and culture medium (single step/multistep medium, oxygen concentration 20%/5%)
Methods: analytical evaluation based on 257 cycles of IVF/ICSI from October 2019 to February 2021, using 2 types of incubator: K-system G-210 3-gas incubator (Australia) (5) %O2, 5%CO2, 90%N2) and Thermo Scientific 371 (Denmark) 2-gas incubator (5%CO2, 75%N2 and using atmospheric Oxygen concentration). Mature oocytes (MI and MII) were cultured in G1-PLUSTM multistep medium (Vitrolife) or Lifeglobal single step medium. Select patients <37 years old, AMH>1.2 ng/ml, AFC≥4. The results of embryo PGT-A screening on day 5 showed that the percentage of abnormal embryos was highest in the group of embryo culture with high oxygen concentration 20% with multistep medium, at 46.02±5.31%, the lowest in low oxygen group 5. %, single step at 30.74±3.50% (f>2.64). When cultured in the same multistep medium, the difference in number of abnormal embryos/cycle was statistically significant with f>3.92. Specifically, in the 5% group it was 1.60±0.22 embryos/cycle while in the 20% oxygen group it was 2.08±0.28 embryos/cycle.
Conclusion: Embryo culture in a low-oxygen environment helped embryos develop fewer chromosomal abnormalities than when cultured at atmospheric concentrations.
Keywords: IVF, culture medium, concentration, chromosomal abnormalities
I. ĐẶT VẤN ĐỀ
Hiện nay, kỹ thuật hỗ trợ sinh sản IVF đang ngày càng được phát triển và hoàn chỉnh hơn, giúp mang lại thành công lớn cho các cặp vợ chồng mong con hiếm muộn. Bên cạnh các nghiên cứu kiểm tra hình thái phôi, các nhà khoa học còn đang tiến hành các xét nghiệm sinh thiết sàng lọc phôi PGT-A để đánh giá chất lượng phôi một cách toàn diện nhất. Kết quả sàng lọc phôi PGT-A cho phép bệnh nhân xác định và lựa chọn được phôi tốt nhất, có tiềm năng phát triển nhất để chuyển vào cơ thể mẹ, giúp cải thiện kết quả thụ tinh ống nghiệm trên mỗi lần chuyển phôi.
Tuy nhiên, để chẩn đoán di truyền trước làm tổ một cách hiệu quả, cần sinh thiết phôi ở giai đoạn phôi nang để lấy được mẩu tế bào đặc trưng nhất, mà không gây ảnh hưởng đến sự phát triển của phôi sau này. Theo đó, môi trường nuôi cấy phôi và nồng độ oxy sẽ là hai trong những nhân tố ảnh hưởng chính đến sự phát triển của phôi trong các giai đoạn, quyết định sự hình thành và chất lượng phôi nang. Thời điểm hiện tại, có hai loại môi trường thương mại đang được sử dụng rộng rãi trong các trung tâm hỗ trợ sinh sản trên thế giới: Môi trường nuôi cấy đơn bước và môi trường nuôi cấy đa bước. Bên cạnh đó, nồng độ oxy cũng là một vấn đề đang được tranh cãi giữa 5% O2 và 20% O2 trong phòng labo. Từ những ngày đầu IVF, các phòng labo luôn sử dụng nồng độ oxy là 20%, tuy nhiên các chuyên gia nghiên cứu thấy rằng nồng độ oxy thực tế trong tử cung mẹ và động vật có vú chỉ giao động trong khoảng 2-8% [1].
Trước đây người ta cho rằng phôi bất thường là do di truyền của bố mẹ, tuổi mẹ, ti thể… nhưng một số nghiên cứu gần đây cho thấy môi trường nuôi cấy và nồng độ oxy có thể ảnh hưởng đến kết quả PGT-A, nhưng chưa đưa ra được khẳng định thống nhất. Mặc dù có nhiều nghiên cứu về vấn đề này, nhưng vẫn chưa đủ bằng chứng để đưa một kết luận cụ thể về mối quan hệ giữa môi trường nuôi cấy và kết quả sàng lọc PGT-A [2] [3]
Thực chất, mỗi phòng Labo Hỗ trợ sinh sản đều có một hệ thống nuôi cấy riêng, điều trị nhóm bệnh nhân đặc thù khác nhau, nên có thể dẫn đến kết quả nghiên cứu khác nhau giữa các trung tâm hỗ trợ sinh sản. Để đóng góp thêm vào kết luận, chúng tôi làm nghiên cứu so sánh kết quả sàng lọc phôi PGT-A (phôi ngày 5) khi nuôi cấy trong môi trường đơn bước (Global total)/môi trường đa bước (G1-PlusTM /G2-PlusTM) và trong nồng độ oxy khí quyển/nồng độ oxy thấp.
II. THỰC NGHIỆM
Nghiên cứu được thực hiện từ tháng 10/2019 đến tháng 2/2021, dựa trên các chu kỳ IVF/tiêm tinh trùng vào bào tương noãn (ICSI) tại Trung tâm hỗ trợ sinh sản, Bệnh viện Đa khoa 16A Hà Đông. Nghiên cứu sử dụng tủ nuôi cấy 3 khí K-system G-210 (Úc) hoặc tủ nuôi cấy 2 khí Thermo Scientific model 371 (Đan Mạch), môi trường nuôi cấy sử dụng là môi trường đa bước G-1, G-2 plus của hãng Vitrolife-Thụy Điển và môi trường nuôi cấy đơn bước Life Global – Mỹ. Các chu kỳ IVF/ICSI được thực hiện trong cùng một phòng Lab với cùng quy trình lâm sàng, quy trình phòng thí nghiệm và vật liệu tiếp xúc. Không có sự thay đổi nhân viên phòng thí nghiệm phôi học, thay đổi duy nhất là thay đổi về môi trường nuôi cấy và nồng độ oxy. Đã có sự chấp thuận của Hội đồng quản trị Trung tâm Hỗ trợ sinh sản, Bệnh viện 16A Hà Đông, dữ liệu được thu thập từ hồ sơ bệnh án của Trung tâm. Nghiên cứu lựa chọn những bệnh nhân có ít nhất 4 nang thứ cấp vào ngày 2 chu kỳ kinh, tuổi mẹ <37 tuổi và chỉ số AMH >1,2 ng/ml. Tổng số chu kỳ IVF/ICSI được đưa vào nghiên cứu là 341 chu kỳ với 3509 phôi.
Bệnh nhân sau khi được kích thích buồng trứng có kiểm soát 9-12 ngày, sau 36 giờ tiêm rụng, bệnh nhân được hút nang qua hướng dẫn siêu âm. Nang trứng được lấy ra và chuyển vào phòng thụ tinh ống nghiệm trong 2 phút, đặt trong tủ ấm 2-4 giờ để chuẩn bị cho chu kỳ ICSI. Sau ICSI, tất cả noãn được đặt vào môi trường rửa (có chứa 10% chất thay thế huyết thanh tổng hợp trong 25 vi giọt) và được phân chia ngẫu nhiên thành 4 nhóm:
Nhóm I: Phôi được nuôi cấy trong tủ 2 khí (20% O2, 6% CO2) với môi trường nuôi cấy đơn bước Lifeglobal.
Nhóm II: Phôi được nuôi cấy trong tủ 2 khí (20% O2, 6% CO2) với môi trường nuôi cấy đa bước Vitrolife. Nuôi phôi ngày 1 trong môi trường G-1TMPLUS; Sang ngày 3 chuyển sang đĩa 4 giếng có chứa môi trường G-2TMPLUS.
Nhóm III: Phôi được nuôi cấy trong tủ 3 khí (5% O2, 6% CO2, 90% N2) với môi trường nuôi cấy đơn bước.
Nhóm IV: Phôi được nuôi cấy trong tủ 3 khí (5% O2, 6% CO2, 90% N2) với môi trường nuôi cấy đa bước Vitrolife. Nuôi phôi ngày 1 trong môi trường G-1TMPLUS; Sang ngày 3 chuyển sang đĩa 4 giếng có chứa môi trường G-2TMPLUS
Tất cả các phôi đều trải qua phân loại chất lượng tiêu chuẩn của ngày 3 và ngày 5 theo phương pháp của đồng thuận Istanbul (Alpha Scientists in Reproductive Medicine (2011) [4]). Sau đó phôi được sinh thiết và mang mẫu đi sàng lọc chẩn đoán tiền làm tổ, kết quả PGT-A được so sánh giữa 4 nhóm môi trường nuôi cấy. So sánh các nhóm phát triển phôi bằng phương pháp phân tích phương sai một yếu tố để đánh giá ảnh hưởng của tác nhân nghiên cứu lên đối tượng nghiên cứu. Kiểm định được sử dụng là kiểm định F.
III. KẾT QUẢ VÀ THẢO LUẬN
Tổng số có 257 chu kỳ thụ tinh ống nghiệm được thực hiện với ít nhất một trứng được thụ tinh. Trong đó, nhóm I có 338 phôi tương đương với 72 chu kỳ, nhóm II có 228 phôi tương đương với 52 chu kỳ, nhóm III có 268 phôi tương đương với 58 chu kỳ, nhóm IV có 328 phôi tương đương với 75 chu kỳ.
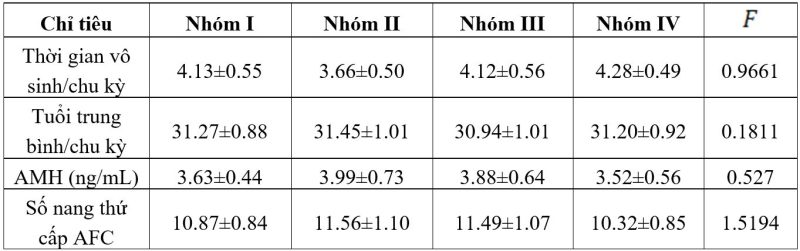
Trong các chu kỳ IVF, ở cả 4 nhóm nghiên cứu, tuổi trung bình của bệnh nhân và thời gian vô sinh tại thời điểm chọc noãn, chỉ như chỉ số nội tiết không có sự khác biệt (bảng 1) (với giá trị f<2.64).
Bảng 1: Phân loại thông tin cơ bản của bệnh nhân
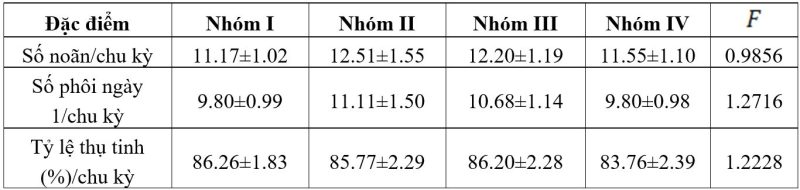
Số noãn trung bình sau chọc hút và số noãn trưởng thành của mỗi bệnh nhân trong bốn nhóm tương đương nhau. Tỷ lệ thụ tinh của các noãn trưởng thành cao, sự khác biệt về tỷ lệ thụ tinh giữa các nhóm không có ý nghĩa thống kê. Tương tự, số lượng phôi trung bình của hai nhóm tương đương nhau (bảng 2).
Bảng 2. Đặc điểm KTBT của các bệnh nhân hai nhóm
Kết quả từ bảng 3 cho thấy, sự khác biệt về số lượng phôi ngày 5 trung bình khi sàng lọc đối với mỗi chu kỳ ở cả 4 nhóm nghiên cứu không có ý nghĩa thống kê, số lượng phôi sàng lọc mỗi nhóm giao động khoảng 4 – 5 phôi mỗi chu kỳ. Sự khác biệt về số lượng phôi bất thường trung bình đối với mỗi chu kỳ cũng như tỷ lệ phôi bất thường cho kết quả có ý nghĩa thống kê f>2.64
Bảng 3. Kết quả sàng lọc PGT phôi ngày 5
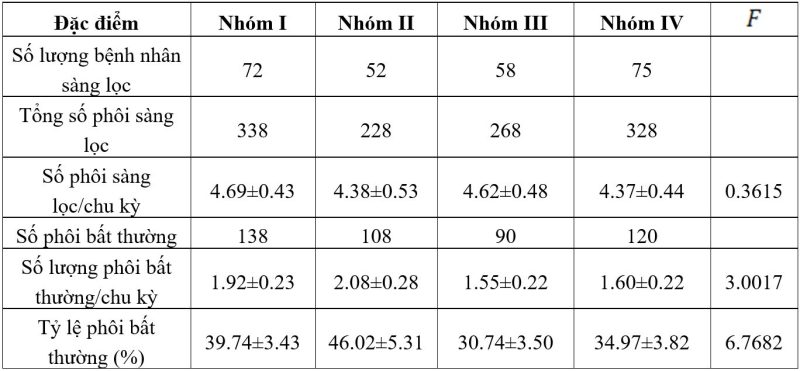
Tỷ lệ phôi bất thường cao nhất ở nhóm nuôi cấy phôi bằng nồng độ oxy cao 20% với môi trường đa bước, ở mức 46.02±5.31%, thấp nhất ở nhóm oxy thấp 5%, đơn bước ở mức 30.74±3.50%.
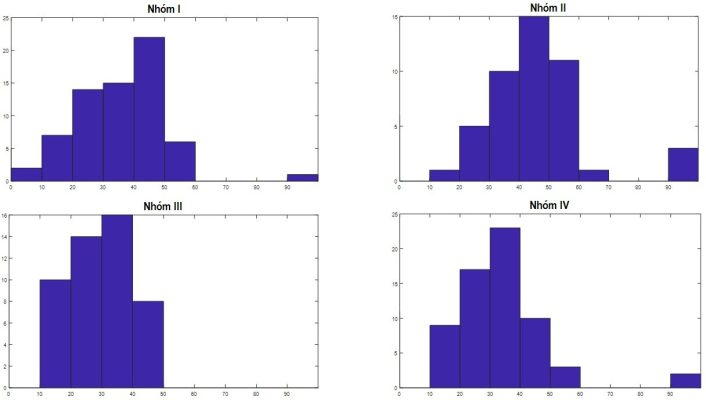
Hình 1. Biểu đồ Histogram về phân bố tỷ lệ phôi bất thường
ở 4 nhóm nghiên cứu (bước dao động 10% trục X).
Từ kết quả hình vẽ, đối với nhóm I và nhóm II cùng được nuôi cấy trong nồng độ oxy cao, tỷ lệ phôi bất thường chiếm cao nhất ở 40-50%. Đối với nhóm III và nhóm IV khi được nuôi cấy trog điều kiện nồng độ oxy thấp, tỷ lệ phôi bất thường chiếm cao nhất ở mốc 30-40%.
Sử dụng so sánh F-kiểm định để phân tích và so sánh sự khác biệt kết quả về bất thường phôi giữa các cặp nhóm nghiên cứu nghiên cứu khi nuôi cấy trong cùng điều kiện (hoặc cùng môi trường, hoặc cùng nồng độ oxy):
Bảng 4. So Sánh sự bất phường nhiễm sắc thể giữa các cặp nhóm nghiên cứu
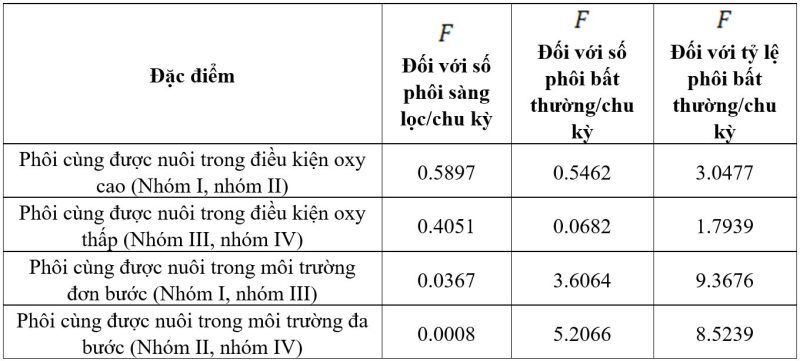
Khi so sánh kết quả sàng lọc phôi bất thường giữa 2 nhóm được nuôi dưỡng (bảng 4):
– Trong cùng điều kiện về nồng độ oxy (khác nhau về loại môi trường nuôi cấy), kết quả cho thấy số lượng trung bình cũng như tỷ lệ về phôi bất thường mỗi chu kỳ có sự khác biệt không có ý nghĩa thống kê với f<3.92
– Trong cùng một loại môi trường nuôi dưỡng (khác nhau về nồng độ oxy), kết quả khi so sánh về số lượng phôi bất thường/chu kỳ cho thấy:
+) Khi nuôi cấy trong cùng môi trường đơn bước, mặc dù f<3.92
(bảng 4) nhưng sự khác biệt về số lượng phôi bất thường/chu kỳ đã bắt đầu có sự khác nhau (1.92±0.23 so với 1.55±0.22 phôi bất thường/chu kỳ) (bảng 3).
+) Khi nuôi cấy trong cùng môi trường đa bước, sự khác biệt về số lượng phôi bất thường/chu kỳ cho kết quả có ý nghĩa thống kê với f>3.92(bảng 4).
Cụ thể, ở nhóm 5% là 1.60±0.22 phôi/chu kỳ trong khi ở nhóm oxy 20% là 2.08±0.28 phôi/chu kỳ (bảng 3).
– Trong cùng một loại môi trường nuôi dưỡng (khác nhau về nồng độ oxy), kết quả khi so sánh tỷ lệ phôi bất thường ở 2 cặp nhóm, sự khác biệt cho ý nghĩa thống kê với f>3.92
(bảng 4). Đối chiếu với bảng 3, cho thấy khi nuôi cấy phôi trong điều kiện oxy thấp 5% cho kết quả tốt hơn, thể hiện ở số lượng phôi bất thường cũng như tỷ lệ phôi bất thường thấp hơn hẳn so với nhóm còn lại.
Thành phần của 2 loại môi trường nuôi cấy là khác nhau, đặc biệt là nguồn bổ sung protein, tồn tại các hợp chất chung giữa hai loại môi trường nhưng nồng độ khác nhau [5] [6]. Bên cạnh đó, mặc dù cả hai loại môi trường đểu được bổ sung albumin huyết thanh của con người nhưng tinh chế theo cách khác nhau, làm ảnh hưởng đến sự tác động của môi trường nuôi cấy đến phôi người. Trong khi môi trường đơn bước cung cấp tất cả các dưỡng chất trong 1 công thức duy nhất, môi trường đa bước hướng tới việc bắt chước các điều kiện sinh lý mà giao tử và phôi được tiếp xúc khi di chuyển từ ống dẫn trứng vào tử cung mẹ. Bên cạnh đó, trên thực tế trong điều kiện cơ thể, noãn và phôi ở giai đoạn phân chia sớm được phát triển trong vòi tử cung ở nồng độ oxy 2 – 5 %. Như vậy việc hạ thấp nồng độ oxy trong điều kiện nuôi cấy phôi xuống dưới 5% có thể thích hợp cho sự thụ tinh và sự phát triển của phôi ở giai đoạn phôi phân chia sớm.
Trong nghiên cứu này, số lượng bệnh nhân, tuổi, chỉ số nội tiết AMH là tương tự nhau ở cả 2 nhóm; vì vậy, có thể so sánh khách quan giữa 4 nhóm với điều kiện nuôi cấy khác nhau (về nồng độ oxy và môi trường nuôi dưỡng). Phân tích sự phát triển của phôi nang: Tỷ lệ phôi cao hơn và chất lượng hình thái phôi tốt hơn đã được quan sát trên phôi ngày 5 với những phôi được nuôi cấy trong môi trường đơn bước, kết quả tương tự với nghiên cứu của Cimandomo et.al [8]. Kết quả sàng lọc phôi PGT-A không có ý nghĩa thống kê đối với tỷ lệ phôi bất thường khi so sánh giữa các nhóm phôi được nuôi cấy ở hai loại môi trường khác nhau (đơn bước và đa bước), dữ liệu này tương quan với kết quả nghiên cứu thử nghiệm SuMMIT [3] – chứng minh rằng tỷ lệ bất thường của phôi nang không bị ảnh hưởng bởi loại môi trường nuôi cấy. Tuy nhiên, nồng độ oxy thấp cho kết quả phôi bất thường nhiễm sắc thể ít hơn nhóm còn lại. Kết quả này có thể được giải thích do nồng độ oxy cao tạo ra nhiều gốc oxy tự do (trong điều kiện bình thường có khoảng 1 – 4% phân tử oxy chuyển thành gốc tự do). Các gốc tự do này là nhân tố khử phản ứng cực mạnh và gây độc cho sinh hoá tế bào, bao gồm cả bộ gen di truyền. Các ADN ty thể rất mẫn cảm với những thay đổi dưới tác động của những chất oxy hóa này, bởi chúng không có protein histon bảo vệ và không có hệ thống sửa chữa sai sót. Điều này dễ dẫn đến hậu quả là làm gia tăng tỷ lệ đột biến, gây ảnh hưởng đến quá trình phiên mã của ARN cũng như quá trình sao mã của chính bản thân ADN ty thể. ADN đột biến sẽ tổng hợp nên các protein bất thường, bản thân các protein này cũng có thể là đích tấn công của các gốc tự do, gây ra những thay đổi về mặt cấu trúc và mất chức năng [9].
V. KẾT LUẬN
Nuôi cấy phôi trong môi trường nồng độ oxy thấp giúp phôi phát triển ít bất thường nhiễm sắc thể hơn so với khi nuôi cấy ở nồng độ khí quyển.
TÀI LIỆU THAM KHẢO
- Fischer B, Bavister BD, “Oxygen tension in the oviduct and uterus of rhesus monkeys, hamsters and rabbits,” J Reprod Fertil , 99, No.2, 1993, pp. 673–679.
- Desai N, Flyckt R, Austin CM., “Can culture medium affect morphokinetics, embryo dysmorphisms and euploidy rate?,” Fertil Steril. vol 108, No.3, 2017, e.160
- https://doi.org/10.1016/j.fertnstert.2017.07.482.
- Werner MD, Hong KH, Franasiak JM, Forman EJ, Reda CV, Molinaro TA, et al., “Sequential versus Monophasic Media Impact Trial (SuMMIT): a paired randomized controlled trial comparing a sequential media system to a monophasic medium.,” Fertil Steril, vol 105, No.5, 2016, pp.1215–21. https://doi.org/10.1016/j.fertnstert.2016.0105.
- ALPHA Scientists in Reproductive Medicin, “The Istanbul consensus workshop on embryo assessment: proceedings of an expert meeting,” Human Reproduction, Vol.26, No.6, 2011, pp.1270-1283, https://doi.org/10.1093/humrep/der037
- Chronopoulou E, Harper JC., “IVF culture media: past, present and future.,” Hum Reprod Update: 21:39-55. Vol 21, No.1, 2014, pp. 39-55 https://doi.org/10.1093/humupd/dmu040.
- Morbeck DE, Krisher RL, Herrick JR, Baumann NA, Matern D, Moyer T. , “Composition of commercial media used for human embryo culture.,” Fertil Steril. Vol.102, No.3, 2014 pp 759–766.e9. https://doi.org/110.1016/j.fertnstert.2014.05.043., 2014.
- Leese HJ, Whitear SL., ” Female tract environment and its relationship to ART media composition. In: Quinn P, editor. Culture media, solutions and systems in human ART,” Cambridge: Cambridge University Press; 2014. p. 21–9.
- Cimadomo D, Scarica C, Maggiulli R, Orlando G, Soscia D, Albricci L, et al. , ” Continuous embryo culture elicits higher blastulation but similar cumulative delivery rates than sequential: a large prospective study.,” J Assist Reprod Genet, vol 35, no.7, 2018 pp.1329–38 https://doi.org/10.1007/s10815-018-1195-4
- Piko L. and Taylor K.D, “Amounts of mitochondrial DNA abundance of mitochondrial gene transcripts in early mouse embryos,” Developmental Biology, vol 123, no.2, 1987, pp. 364-374. https:// org/10.1016/0012-1606(87)90395-2
( Nguồn: Số 518, tháng 9/2022, Tạp chí Y Học Việt Nam, trang 208-215, link full tạp chí: ![]() )
)
