Đặng Tiến Trường1, Bùi Thu Anh1, Trần Hồng Loan2
1Học Viện Quân y
2Công Ty TNHH KHKT&DV Genome
Chịu trách nhiệm chính: Đặng Tiến Trường
Email: truongdt@vmmu.edu.vn
Ngày nhận bài: 23/7/2022
Ngày phản biện khoa học: 08/08/2022
Ngày duyệt bài: 26/08/2022
SUMMARY
PREIMPLANTATION GENETIC TESTING ON HEMOPHILIA B
Objectives: Here we report the case of successfully performing PGT-M in a HEMB patient with single point mutation.
Materials methods: There was a family with the mother with c.192T>G mutation, the father with no mutation, the first daughter carrying the mutation, and the second son with HEMB disease. Four blastocysts were biopsied. We designed one primer targeted at AMELX gene and seven primers targeted at STRs of F9 gene. Whole-genome amplification of blastocysts was performed successfully. Haplotypes as markers for linkage analysis were established. Sanger sequencing assay was performed to determine single point mutations.
Results: We performed PGT-M by establishing a pedigree with genetic linkage analysis and determining the single point mutation (c.192T>G) in the F9 gene that leads to HEMB. The results from the two methods were similar. The results indicated that the third and fourth blastocysts carry the mutation, the second blastocyst has no mutation. In the result of Sanger sequencing assay of the first blastocyst, two peaks of T and G occurred at the point of mutation. Based on both two results, we concluded that the first blastocyst carries the mutation.
Conclusion: We successfully determined the blastocyst that carries the mutation. Our study suggests that our protocol is able to improve the accuracy of PGT-M test and can be used in PGT-M of various diseases.
Keywords: Hemophilia B; HEMB; STR; PG
I. ĐẶT VẤN ĐỀ
Bệnh Hemophilia B (HEMB) hay còn gọi là bệnh máu khó đông B là bệnh di truyền hiếm gặp liên quan đến quá trình đông máu. Bệnh nhân HEMB thiếu hụt yếu tố đông máu IX khiến quá trình đông máu không thể xảy ra, gây ra mất máu dẫn đến tử vong. Bệnh HEMB là kết quả của đột biến trên gen F9 của nhiễm sắc thể X. Trên toàn thế giới, tỷ lệ trẻ nam sinh ra bị mắc bệnh HEMB là 1 trên 30000. Nghiên cứu chỉ ra rằng có hơn 3000 đột biến trên gen F9 có thể dẫn đến bệnh HEMB[4], [9].
Hiện nay, chúng ta chỉ có giải pháp tình thế đưa các yếu tố đông máu từ bên ngoài vào cơ thể trong trường hợp bệnh nhân bị thương không thể cầm máu[7], [8]. Do vậy, đối với những gia đình có tiền sử bị bệnh việc dự phòng để sinh những thế hệ sau không mang gen bệnh rất quan trọng.
Xét nghiệm rối loạn di truyền đơn gen trước chuyển phôi (Preimplantation genetic testing for monogenic disorders, PGT-M) là một công cụ vô cùng hiệu quả đối với bệnh nhân có nguy cơ cao truyền lại những bất thường về gen cho thế hệ tiếp theo. Mục đích của xét nghiệm này nhận diện những đặc điểm di truyền bất thường trong mẫu phôi, cho phép lựa chọn và chuyển những phôi không mang gen bệnh. Do vậy, PGT-M có thể giảm đồng thời trường hợp đình chỉ thai và nguy cơ mắc bệnh di truyền cho thế hệ sau[3]. Tuy nhiên, xét nghiệm này vẫn tiềm tàng nhiều nguy cơ dẫn đến sai lệch kết quả. Một nguy cơ thường xuyên xuất hiện nhất là hiện tượng mất alen (Allel Dropout, ADO) và ngoại nhiễm. Việc xây dựng một quy trình xét nghiệm để kiểm soát ADO và ngoại nhiễm DNA là vô cùng quan trọng[1]. Mặt khác, không có một mẫu số chung cho tất cả các đột biến cũng là một thách thức trong lĩnh vực PGT-M. Do vậy, để đưa ra những chẩn đoán chính xác, thiết kế các thí nghiệm cần được cá nhân hóa và tùy chỉnh để phù hợp tới gen khác nhau[2].
Hiện nay, một kỹ thuật đang được sử dụng rộng rãi là phân tích các trình tự lặp ngắn (Short tandem repeat, STR). STR là các trình tự ngắn từ 2 đến 6bp, được lặp lại nhiều lần (10 đến 60) xuất hiện phổ biến trong hệ gen của con người. STR có đặc điểm là tính đa hình cao và liên kết chặt chẽ với một gen đích, do vậy, đây là những dấu hiệu quan trọng có thể sử dụng trong chẩn đoán bệnh lý di truyền.
Tại một số trung tâm di truyền ở Việt Nam, PGT-M đã được thực hiện trong một vài năm trở lại. Tuy nhiên, chúng ta vẫn chưa xây đựng được một bộ quy chuẩn để kiểm soát kết quả chẩn đoán PGT-M. Bài báo này báo cáo một trường hợp gia đình thực hiện PGT-M bệnh HEMB thành công sử dụng phương pháp trực tiếp và gián tiếp.
II. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Đối tượng nghiên cứu
Gia đình gồm người vợ mang đột biến c.192T>G, p.Cys64Trp trên exon hai gen F9 của nhiễm sắc thể X, người chồng không mang đột biến. Cặp vợ chồng có hai người con trong đó con gái mang gen đột biến, con trai bị bệnh. Hai vợ chồng tham gia thực hiện IVF thu được bốn phôi ngày năm. Bộ marker STR phục vụ chẩn đoán PGT-M được thiết lập thành công trên gia đình và tiến hành chẩn đoán trên 4 mẫu sinh thiết từ phôi thu được.
2.2. Phương pháp nghiên cứu
Thiết kế bộ chỉ thị STR cho gia đình nghiên cứu
Chúng tôi tiến hành tách ADN từ 200µL mẫu máu của bố mẹ và con trai bằng bộ QIAamp DNA Mini Kit (QIAGEN). Kĩ thuật giải trình tự Sanger được sử dụng để xác định trực tiếp các đột biến của các thành viên trong gia đình.
Bộ chỉ thị gồm tám STRs trong đó một STR liên kết với với gen AMELX (một gen đơn bản nằm trên cả nhiễm sắc thể X và Y), bảy STR có chỉ số đa hình cao liên kết với gen F9 trên nhiễm sắc thể X được khảo sát trên mẫu máu của gia đình bằng phương pháp Multiplex PCR và điện di mao quản. Phản ứng PCR để khuếch đại các đoạn lặp ngắn được thực hiện trong ống PCR tổng thể tích 50 µL bao gồm 1X QIAGEN Multiplex PCR Master Mix, 50-100 ng DNA, 0.01-0.4 µM mỗi mồi. Chu trình nhiệt được thực hiện trên máy PCR ProFlex 3×320-wells (Applied Biosystems), gồm bước hoạt hóa enzyme ban đầu 950C trong 15 phút, 32 chu kỳ gồm biến tính ở 940C trong 30 giây, gắn mồi ở 600C trong 90 giây, kéo dài ở 720C trong 1 phút, và gia tăng thêm 6 giây sau mỗi chu kỳ và kéo dài cuối cùng ở 600C trong 30 phút.
Sau đó tiếp tục PCR vòng hai để gắn màu huỳnh quang, thể tích 20 µL bao gồm 1X QIAGEN Multiplex PCR Master Mix, 1 µL sản phẩm PCR vòng 1, 0.2 µM mỗi mồi gắn huỳnh quang HEX, FAM, NED. Điều kiện thực hiện PCR tương tự như quy trình trên.
Khảo sát trên mẫu sinh thiết phôi
Phôi ngày năm được sinh thiết và tiến hành khuếch đại toàn bộ hệ gen (WGA), sau đó sản phẩm sau WGA được tiến hành theo các bước Multiplex PCR, điện di mao quản và giải trình tự Sanger để xác định tình trạng của từng phôi.
III. KẾT QUẢ NGHIÊN CỨU
3.1. Xác định bộ haplotype của mẫu gia đình và mẫu sinh thiết phôi
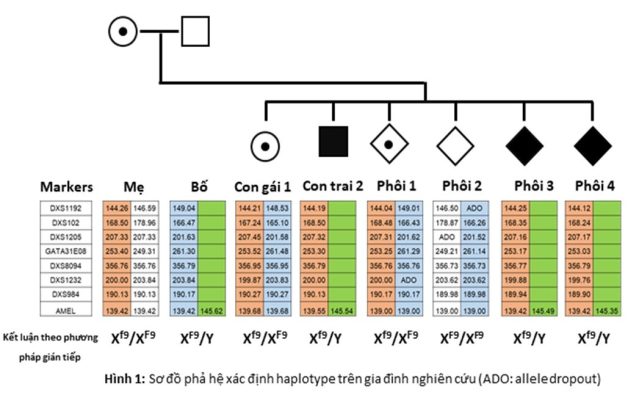
Bệnh HEMB là bệnh liên quan đến rối loạn di truyền lặn trên nhiễm sắc thể X. Do vậy, ở bước đầu tiên, chúng tôi đặt mục tiêu xác định bộ haplotype liên kết với nhiễm sắc thể giới tính của các mẫu gia đình.
Trong nghiên cứu này, chúng tôi sử dụng tám cặp mồi. Một cặp mồi khuếch đại gen AMELX, một gen đơn bản nằm trên vùng Xp22.1-Xp22.3 của nhiễm sắc thể X và vùng Yp11.2 của nhiễm sắc thể Y. Bảy cặp mồi còn lại liên kết đến gen F9 của nhiễm sắc thể giới tính X[10]. Kết quả phân tích haplotype của gia đình được trình bày trên hình 1. Bộ haplotype của các thành viên trong gia đình được xắp xếp thành các cột, được đánh dấu bằng màu màu sắc.
Bộ haplotype của mẹ là cột màu da cam và màu trắng. Bộ haplotype của bố là cột màu xanh dương và xanh lá cây. Vì cột màu xanh chỉ thể hiện kết quả khuếch đại của duy nhất một cặp mồi AMEL, chúng tôi kết luận rằng cột màu xanh là bộ haplotype liên kết với nhiễm sắc thể Y. Cột màu dương là bộ haplotype liên kết với nhiễm sắc thể X.
Bộ haplotype của người con gái là màu da cam và màu xanh dương. Trong đó cột màu da cam di truyền từ người mẹ, cột màu xanh dương di truyền từ người bố. Như đã đề cập trong phần phương pháp nghiên cứu, vì người con gái mang gen bệnh HEMB liên kết với nhiễm sắc thể X di truyền từ người mẹ, chúng tôi kết luận rằng cột màu da cam là bộ haplotype chứa gen đột biến.
Kết luận này được xác nhận lại một lần nữa thông qua bộ haplotype của người con trai. Bộ haplotype của con trai bị bệnh là cột màu da cam và màu xanh lá cây. Cột màu xanh lá cây là bộ haplotype liên kết với nhiễm sắc thể Y di truyền từ người bố. Cột màu da cam là bộ haplotype liên kết với nhiễm sắc thể X chứa gen mang bệnh là nguyên nhân gây bệnh cho người con trai.
Bước thứ hai chúng tôi tiến hành xác định bộ haplotype trên mẫu sinh thiết phôi (Hình 1). Kết quả phân tích gen cho thấy phôi một, ba và bốn mang bộ haplotype liên kết gen mang bệnh của nhiễm sắc thể X (cột màu cam), do vậy, chúng tôi kết luận phôi một, ba, bốn là phôi mang bệnh. Hơn thế nữa, phôi ba và phôi bốn mang bộ haplotype liên kết với nhiễm sắc thể Y (cột màu xanh lá cây), do đó chúng tôi kết luận phôi ba và bốn là phôi nam mang bệnh. Phôi một nhận bộ haplotype liên kết nhiễm sắc thể X từ người bố do vậy phôi một là phôi nữ mang bệnh. Phôi hai nhận bộ haplotype không liên kết với gen mang bệnh của nhiễm sắc thể X (cột màu trắng), do vậy, chúng tôi kết luận phôi hai là phôi không mang bệnh. Đồng thời, chúng tôi cũng xác định phôi thứ hai là phôi nữ bởi vì phôi thứ hai được di truyền bộ haplotype liên kết với nhiễm sắc thể X từ bố.
3.2. Xác định đột biến của các mẫu gia đình và sinh thiết phôi
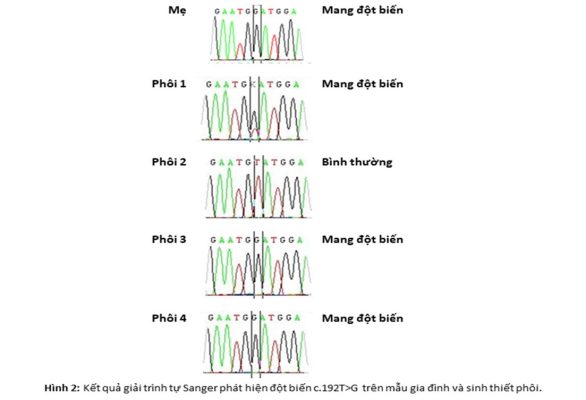
Chúng tôi tiến hành phân tích xác định đột biến bằng kỹ thuật giải trình trực tiếp Sanger (Hình 2). Kết quả cho thấy phôi số hai chỉ có duy nhất một một đỉnh đồng hợp T. Điều này, chỉ ra rằng phôi hai không mang gen đột biến. Phôi ba và bốn chỉ có duy nhất một đỉnh đồng G, chỉ ra rằng phôi ba và bốn mang một đỉnh đột biến c.192T>G. Kết quả này phù hợp với kết quả phân tích di truyền liên kết gen. Khác với các phôi còn lại, đối với phôi một, kết quả giải trình tự Sanger cho thấy xuất hiện đồng thời hai đỉnh T và G tại điểm đột biến, do vậy chưa thể kết luận tình trạng phôi một. Vì bộ STR được sử dụng có tính đa hình cao, liên kết chặt chẽ với gen F9 ở vùng trước và vùng sau, chúng ta có thể sử dụng kết quả phân tích di truyền liên kết gen của phôi để đưa ra kết luận về tình trạng phôi. Kết quả phân tích di truyền liên kết gen của phôi một chỉ ra rằng phôi một mang nhiễm sắc thể X chứa gen đột biến. Vì vậy, phôi một được kết luận là phôi mang bệnh.
IV. BÀN LUẬN
Bệnh máu khó đông (Hemophilia B, HEMB) là bệnh lí di truyền lặn nhiễm sắc thể giới tính, do đột biến gen F9. Bệnh nhân mang đột biến gen F9 thiếu hụt yếu tố đông máu IX, khiến cho quá trình đông máu không thể xảy ra. Người bệnh máu khó đông có thể xảy ra tình trạng chảy máu không kiểm soát gây tử vong. Hiện nay, chúng ta chưa có thuốc điều trị tận gốc bệnh này.
Chẩn đoán di truyền trước chuyển phôi (Preimiplantation Genetic Testing – PGT) là một loại chẩn đoán thường được đề xuất để tầm soát bệnh di truyền đối với gia đình có gen mang bệnh. Xét nghiệm này cho phép lựa chọn các phôi không mang gen bệnh để chuyển vào tử cung người mẹ, giúp họ sinh ra những đứa con khỏe mạnh. Tối ưu hóa độ chính xác trong kĩ thguật xét nghiệm PGT là vấn đề vô cùng quan trọng, liên quan trực tiếp đến kết quả chẩn đoán.
Trong nghiên cứu này, chúng tôi tiến hành chẩn đoán PGT-M bằng cả phương pháp gián tiếp và trực tiếp. Đối với phương pháp gián tiếp, chúng tôi sử dụng bộ haplotype như những dấu hiệu trong phân tích liên kết gen. Chúng tôi đã thiết kế thành công bộ haplotype chỉ thị gồm tám STRs có chỉ số đa hình cao, phân bố ở cả trước và sau gen F9. Đồng thời, bộ chỉ thị của chúng tôi còn có giá trị trong việc xác định giới tính của phôi. Đối với phương pháp trực tiếp, chúng tôi tiến hành phân tích trình tự đột biến bằng kỹ thuật Sanger. Chúng tôi đã phát hiện đột biến c.192T>G trên gen F9 ở mẫu người mẹ; đây là đột biến gây bệnh.
Chẩn đoán di truyền trước chuyển phôi là một lĩnh vực khó tiếp cận bởi nhiều nguyên nhân. Trong đó, một nguyên nhân cốt lõi đó là số lượng mẫu rất ít (một vài tế bào ngoại bì lá nuôi phôi) và chỉ được thực hiện một lần duy nhất do vậy không đánh giá được sự ổn định của kết quả. Hệ gen của các mẫu phôi sinh thiết được nhân lên bằng kĩ thuật khuếch đại toàn bộ hệ gen (Whole genome amplification – WGA) là giải pháp của vấn đề này. Tuy nhiên, khi thực hiện chẩn đoán di truyền trên mẫu WGA, hiện tượng ADO
và ngoại nhiễm dẫn tới kết quả sai lên đến 30%[5], [6].
Theo Hiệp hội hỗ trợ sinh sản sản và phôi học Châu Âu (ESHRE), để tăng độ chính xác của chẩn đoán di truyền trước phối cần thực hiện đồng thời chẩn đoán trực tiếp và gián tiếp[5]. Quy trình chúng tôi đề xuất dựa theo khuyến cáo của hiệp hội sinh sản và phôi học châu Âu bao gồm chẩn đoán trực tiếp bằng phương pháp giải trình tự Sanger và chẩn đoán gián tiếp bằng phương pháp phân tích liên kết gen dựa trên các bộ haplotype. Trong nghiên cứu của chúng tôi, kết quả chẩn đoán mẫu phôi của cả hai phương pháp là trùng khớp nhau. Kết quả này củng cố vai trò của việc sử dụng đồng thời hai phương pháp trong việc chẩn đoán di truyền trước phôi.
V. KẾT LUẬN
Chúng tôi đã thực hiện thành công chẩn đoán trước chuyển phôi cho 4 phôi của gia đình có tiền sử bị bệnh HEMB, trong đó sàng lọc một phôi không mang gen bệnh. Quy trình của chúng tôi có thể được áp dụng đối với các đột biến điểm khác trên gen F9.
TÀI LIỆU THAM KHẢO
[1] Blais J. et al. (2015), “Risk of Misdiagnosis Due to Allele Dropout and False-Positive PCR Artifacts in Molecular Diagnostics: Analysis of 30,769 Genotypes”, J Mol Diagn. 17 (5), pp. 505-514.
[2] Chen M. et al. (2016), “Preimplantation genetic diagnosis of hemophilia A”, Thromb J. 14 (Suppl 1), pp. 33.
[3] De Rycke M. et al. (2020), “Preimplantation Genetic Testing for Monogenic Disorders”, Genes (Basel). 11 (8).
[4] Goodeve A. C. (2015), “Hemophilia B: molecular pathogenesis and mutation analysis”, J Thromb Haemost. 13 (7), pp. 1184-1195.
[5] Group E. P.-M. W. et al. (2020), “ESHRE PGT Consortium good practice recommendations for the detection of monogenic disorders”, Hum Reprod Open. 2020 (3), pp. hoaa018.
[6] Harton G. L. et al. (2011), “ESHRE PGD consortium best practice guidelines for fluorescence in situ hybridization-based PGD”, Hum Reprod. 26 (1), pp. 25-32.
[7] Horava S. D. et al. (2017), “Recent advances in hemophilia B therapy”, Drug Deliv Transl Res. 7 (3), pp. 359-371.
[8] Leebeek F. W. G. et al. (2021), “Gene therapy for hemophilia: a review on clinical benefit, limitations, and remaining issues”, Blood. 138 (11), pp. 923-931.
[9] Rallapalli P. M. et al. (2013), “An interactive mutation database for human coagulation factor IX provides novel insights into the phenotypes and genetics of hemophilia B”, J Thromb Haemost. 11 (7), pp. 1329-1340.
[10] Tozzo P. et al. (2013), “Deletion of amelogenin Y-locus in forensics: literature revision and description of a novel method for sex confirmation”, J Forensic Leg Med. 20 (5), pp. 387-391.
( Nguồn: Số 518, tháng 9/2022, Tạp chí Y Học Việt Nam, trang 172-178, link full tạp chí: ![]() )
)
