Đặng Thị Hồng1, Trần Văn Khoa1, Lê Thị Kim Dung1, Nguyễn Văn Phong1, Phạm Trường Giang1, Trần Khánh Linh2
1Học viện quân y
2Đại học Khoa học Tự nhiên, Đại học quốc gia Hà Nội
Chịu trách nhiệm chính: Đặng Thị Hồng,
Trần Văn Khoa
Email: tvkhoabio@gmail.com
Ngày nhận bài: 26/7/2022
Ngày phản biện khoa học: 10/08/2022
Ngày duyệt bài: 29/08/2022
SUMMARY
SURVEY ON EPSTEIN –BARR VIRUS INFECTION RATES AND TYPOLOGY IN SALIVA SAMPLES OF
18-25 YEAR OLDS
Epstein-Barr Virus (EBV) is a member of the Human Herpes virus group 4, infecting communities around the world. EBV is a factor involved in the progression mechanism of a number of host diseases such as infectious mononucleosis, Burkitt lymphoma, nasopharyngeal carcinoma (UCVH), etc. EBV typing plays an important role in the research and in-depth understanding of the mechanism of cancer progression. In addition, determining the infection rate for each type in the population and in each type of cancer is also a scientific basis for designing EBV vaccines. Objectives: i) Standardize the procedure for determining EBV type in saliva samples; ii) To study the prevalence of EBV infection and the rate of each strain of EBV in young people aged 18-25 years old. Subjects and methods: Saliva samples of 131 healthy young men (91 men and 50 women) aged 18-25 years old were extracted DNA and determined for EBV infection, EBV type determination by Nested-PCR. Results: 1, Standardized the process of determining EBV type in saliva samples of young people by Nested-PCR technique; 2, The saliva sample of healthy young adults (18-25 years old) had an EBV infection rate of 50.38%, of which: EBV type 1 infection rate was 36.64%; the rate of EBV type 2 infection was 7.63% and the rate of co-infection with both types was 6.87%; 3, There were no major differences in the prevalence of EBV infection and the prevalence of each strain in saliva samples between the sexes in healthy young adults (18-25 years of age).
Key words: EBV, typing.
I. ĐẶT VẤN ĐỀ
Epstein-Barr Virus (EBV) được phát hiện lần đầu vào năm 1964 bởi Epstein và cộng sự, là virus thuộc nhóm Human Herpes virus 4, lây nhiễm nhiễm phổ biến trong các cộng đồng trên toàn cầu. Số liệu được CDC Hoa Kỳ ước tính, có đến 90% người trưởng thành có bằng chứng từng nhiễm EBV trước đó [1]. Tính lây nhiễm phổ biến của EBV bắt nguồn từ đặc điểm lây truyền dễ dàng qua đường miệng, thông thường nhất bởi nước bọt từ những cá thể nhiễm EBV; ngoài ra ghép tạng và truyền máu cũng là đường lây truyền bệnh [2-3]. Virus gây sơ nhiễm và tồn tại lâu dài trong cơ thể mà không gây bệnh cho vật chủ. Tuy nhiên trong một số trường hợp, EBV lại là yếu tố tham gia vào cơ chế tiến triển của một số bệnh ở vật chủ như bệnh tăng bạch cầu đơn nhân nhiễm khuẩn, tăng sinh lympho B hay u lympho Burkitt, bệnh Hodgkin, một số dạng T-lymphoma, ung thư biểu mô vòm họng (UTVH)… Chúng được cho là nguyên nhân của khoảng 200,000 ca mắc ung thư mỗi năm trên toàn cầu [4-5].
Hệ gen EBV có cấu trúc DNA sợi đôi, dài khoảng 184kps mã hóa cho hơn 85 gen trong đó có ba họ gen đóng vai trò quan trọng: EBNAs (EBV nuclear antigens), LMPs (Latent membrane proteins) và EBERs (Non-coding nuclear RNAs) [6]. Dựa vào khác biệt trình tự kháng nguyên do một số gen mã hoá (EBNA2-A và EBNA2-B hoặc EBNA3-A, EBNA3-B và EBNA3-C), EBV được chia làm 2 typ: EBV typ 1 (typ A) và EBV typ 2 (typ B). Hai typ này khác nhau về khả năng biến đổi và khả năng tái hoạt trong vật chủ. Việc định typ EBV có vai trò quan trọng trong nghiên cứu và đi sâu tìm hiểu cơ chế tiến triển của các loại ung thư. Ngoài ra, xác định tỷ lệ nhiễm từng typ trong quần thể và trong từng loại ung thư còn là cơ sở khoa học để thiết kế vaccin phòng EBV. Tại Việt Nam, các nghiên cứu tập chung chủ yếu về mối liên quan giữa EBV và các giá trị marker của nó trong các loại ung thư. Chưa thực sự có một nghiên cứu nào bài bản với cỡ mẫu lớn được thực hiện trên thanh niên để xác định tỷ lệ nhiễm EBV và tỷ lệ từng typ. Chính vì vậy, xuất phát từ ý nghĩa thực tiễn mang lại và mong muốn góp phần bổ sung vào bản đồ thế giới về tỷ lệ nhiễm EBV, chúng tôi tiến hành đề tài: “Xác định tỷ lệ nhiễm Epstein-Barr Virus và định typ trong mẫu nước bọt ở thanh niên độ tuổi 18-25” với hai mục tiêu:
- Chuẩn hóa quy trình xác định typ EBV trong mẫu nước bọt của thanh niên.
- Khảo sát tỷ lệ nhiễm EBV và tỷ lệ từng chủng EBV ở thanh niên khoẻ mạnh độ tuổi 18-25.
II. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
- Đối tượng nghiên cứu
Mẫu nước bọt của 131 người khoẻ mạnh (91 nam và 50 nữ) lứa tuổi từ 18-25 tuổi.
- Phương pháp nghiên cứu
2.1. Kỹ thuật tách chiết và bảo quản DNA từ mẫu nước bọt
Mẫu nước bọt thu được từ các đối tượng được bảo quản trong các ống falcon chứa 5ml dung dịch bảo quản trước khi tiến hành tách chiết DNA bằng bộ Kit QIAamp DNA mini Kit (Đức). Quy trình tách chiết được thực hiện theo hướng dẫn của nhà sản xuất. Dung dịch SDS và proteinase K sử dụng để phá vỡ nhân tế bào niêm mạc miệng và phân hủy protein. DNA được phân tách theo phương pháp cột silica. Nồng độ DNA và độ tinh sạch từ các mẫu bệnh phẩm sau tách chiết được xác định bằng máy đo SpectraMax QuickDrop, đảm bảo lượng DNA tổng số trong khoảng 10-20 pg, độ tinh sạch A260/280 từ 1,8-2,2. Các mẫu không đảm bảo tiêu chuẩn được tiến hành tinh sạch lại cho đến khi đạt yêu cầu, sau đó được bảo quản ở -20°C trước khi tiến hành PCR và giải trình tự gen.
2.2. Phản ứng Nested-PCR định typ EBV
Các cặp mồi được nhóm nghiên cứu lựa chọn và kiểm tra để khuếch đại đoạn gen EBNA2-A và EBNA2-B bằng cách sử dụng phần mềm Primer-BLAST.
Bảng 1: Trình tự mồi khuếch đại đoạn gen EBNA2-A và EBNA2-B.

Tất cả các mồi sử dụng trong phản ứng đều có nhiệt độ nóng chảy xấp xỉ trong khoảng 52ºC -58.5ºC, trong đó EBNA-2F và EBNA-2I khuếch đại cho đoạn gen vòng ngoài (801bp); cặp mồi EBNA-2C và EBNA-2G khuếch đại đoạn gen EBNA2-A(250bp); EBNA-2C và EBNA-2B cho đoạn gen EBNA2-B với kích thước 300bp.
Ngoài ra, nhóm nghiên cứu cũng sử dụng trong phản ứng cặp mồi β-globin F và β-globin R khuếch đại đoạn gen beta-globin (119bp), như chứng nội nhằm mục đích kiểm tra chất lượng mẫu ADN tách chiết.
Bảng 2: Trình tự mồi khuếch đại đoạn đoạn gen beta-globin.

Sau khi chạy phản ứng Nested-PCR, sản phẩm khuếch đại được kiểm tra bằng phương pháp điện di trên gel agarose 3%, qua đó mẫu sẽ được xác định dương tính với EBV hay không và loại typ EBV tương ứng.
2.3. Giải trình tự Sanger
Các đoạn gen EBNA2-A và EBNA2-B đã được khuếch đại ở trên được sử dụng để giải trình tự trên máy SeqStudio bằng bộ kit BigDye® Terminator v3.1 Cycle Sequencing của hãng Thermo Fisher Scientific.
Thành phần của mỗi phản ứng Sanger gồm 3.2 pM mồi xuôi hoặc mồi ngược; 50ng DNA, 1 μl BigDye, 2 μl Buffer và nước tương ứng trong tổng thể tích 10 μl với chu trình nhiệt như sau: 96°C – 1 phút; 25 chu kỳ (96°C – 10 giây, 50°C – 5 phút, 60°C – 4 phút); giữ ở 4°C. Sản phẩm được tinh sạch bằng phương pháp tủa EtOH/EDTA. DNA thu được đem đi điện di mao quản. Trình tự nucleotid của mỗi đoạn gen được xác định cả 2 chiều (xuôi và ngược) bằng phần mềm Bioedit Sequence Alignment Editor. Các mẫu được xác định dương tính và định typ được sử dụng làm chứng dương.
III. KẾT QUẢ NGHIÊN CỨU
- Kết quả chuẩn hoá quy trình phản ứng Nested-PCR định typ EBV
Phản ứng Nested-PCR được tiến hành 2 vòng:
– Vòng 1: mỗi ống phản ứng có thể tích 12.5 μl trong đó chứa 6.25 μl GoTaq Green Mastermix 2X (Lot.No. 0000440041; HSD: 05/2023); 1.75 μl nước; 0.5 μl mỗi mồi EBNA-2F, EBNA-2I, β-globin F và β-globin R; 2.5 μl DNA template.
Dựa vào nhiệt độ nóng chảy của các cặp mồi, phản ứng PCR được thực hiện với dải gradient nhiệt độ gắn mồi từ 50-60℃ và dựa vào kết quả phản ứng này, nghiên cứu lựa chọn được 52℃ làm nhiệt độ gắn mồi tối ưu nhất. Phản ứng này được lặp đi lặp lại 3 lần và kết quả các lần thực hiện là đồng nhất.
Chu trình nhiệt đã thực hiện với phản ứng vòng 1:
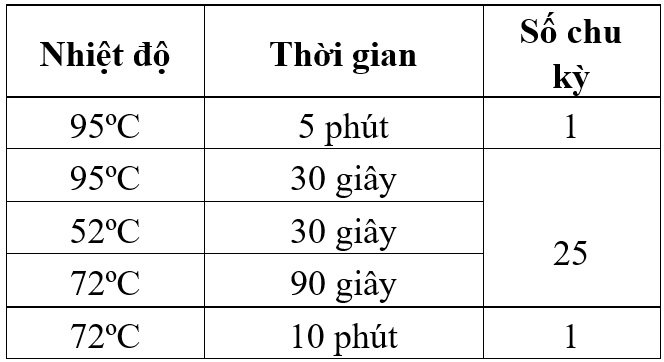
– Vòng 2: mỗi ống phản ứng có thể tích 12.5 μl gồm 6.25 μl GoTaq Green Mastermix 2X; 4.25 μl nước; 0.5 μl mỗi mồi EBNA-2C, EBNA-2G, EBNA-2B; 1.0 μl sản phẩm PCR vòng 1.
Tương tự như phản ứng PCR vòng 1, dựa trên nhiệt độ nóng chảy của các cặp mồi, phản ứng PCR vòng 2 cũng được thực hiện với dải gradient nhiệt độ gắn mồi từ 50-60℃ và dựa vào kết quả, nghiên cứu lựa chọn được 52℃ làm nhiệt độ gắn mồi tối ưu nhất.
Chu trình nhiệt vòng 2:
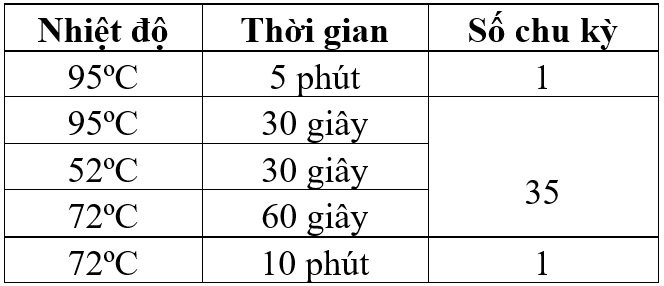
Sau phản ứng Nested-PCR, sản phẩm được điện di trên gel agarose 3%, trên các mẫu xuất hiện băng 250bp và 300bp (tương ứng với kích thước đoạn gen EBNA2-A và EBNA2-B mà nhóm nghiên cứu đã thiết kế). Ngoài ra, các mẫu đều xuất hiện băng 119bp (tương ứng kích thước đoạn gen β-globin đã thiết kế), chứng tỏ quy trình tách chiết DNA được thực hiện đảm bảo chất lượng, tránh hiện tượng âm tính giả.
- Kết quả xác định tỷ lệ nhiễm EBV và định typ trên các nhóm đối tượng
Kết quả xác định mẫu mắc EBV và định typ trên nhóm nam giới khoẻ mạnh:
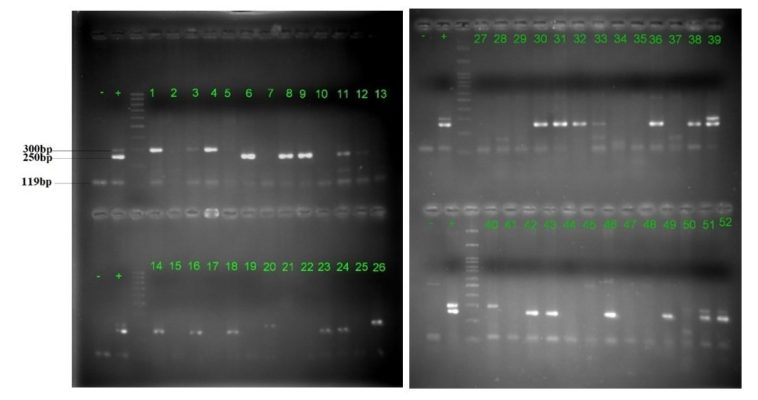
Hình 1: Kết quả điện di sản phẩm Nested-PCR trên gel agarose 3% của các đối tượng thuộc nhóm nam giới khoẻ mạnh.
– : Chứng âm + : Chứng dương.
1-91: Các mẫu nhóm nam giới đã được đánh số từ 1 đến 91.
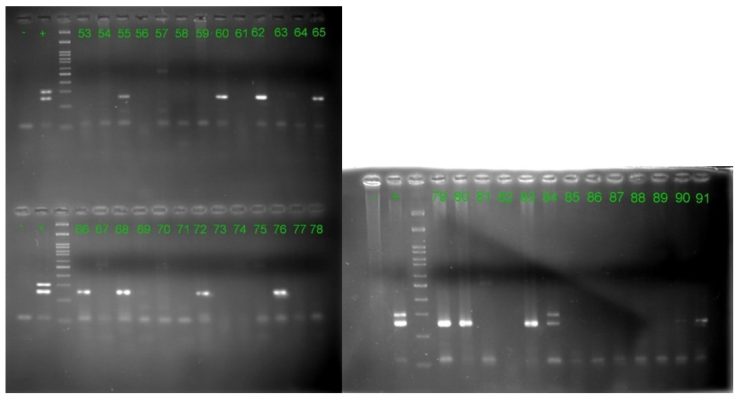
Kết quả xác định mẫu mắc EBV và định typ trên nhóm nữ giới khoẻ mạnh:
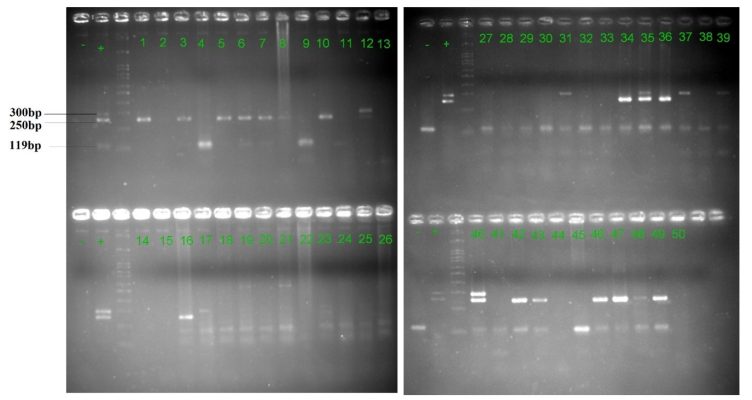
Hình 2: Kết quả điện di sản phẩm Nested-PCR trên gel agarose 3%
của các đối tượng thuộc nhóm nữ giới khoẻ mạnh.
– : Chứng âm + : Chứng dương.
1-50: Các mẫu nhóm nữ giới đã được đánh số từ 1 đến 50.
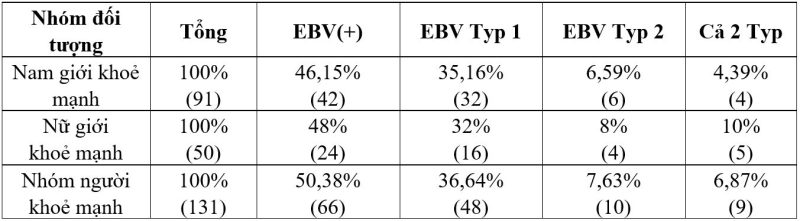
Bảng 3: Tỷ lệ nhiễm EBV và tỷ lệ từng typ trong mẫu nước bọt nhóm khoẻ mạnh.
IV. BÀN LUẬN
Sau khi xây dựng quy trình Nested-PCR, nhóm nghiên cứu tiến hành chạy trên các mẫu nghiên cứu. Kết quả kiểm tra sản phẩm Nested-PCR bằng điện di agarose 3% cho thấy chúng tôi đã khuếch đại được các đoạn gen có kích thước như đã thiết kế (250bp và 300bp). Để xác định các sản phẩm có kích thước 250bp và 300bp là các đoạn gen EBNA2-A (typ 1) và EBNA2-B (typ 2) đã được khuếch đại, nhóm nghiên cứu đã tiến hành giải trình tự trên một số mẫu đại diện. Các băng sản phẩm Nested-PCR sau khi được kiểm tra bằng điện di sẽ được đem giải trình tự theo nguyên lý Sanger để so sánh.
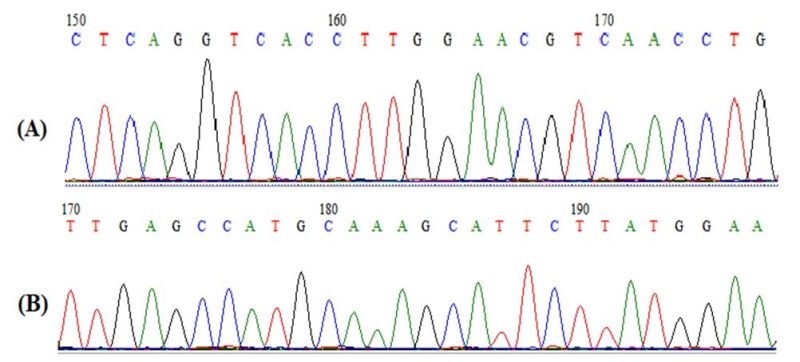
Hình 3: Kết quả giải trình tự Sanger sản phẩm khuếch đại gen EBNA2-B:
(A): Mồi EBNA2-C; (B): Mồi EBNA2-B
Kết quả giải trình tự cho thấy các peak của sản phẩm đều rõ ràng, trừ một số nucleotide tại phần đầu của trình tự do vị trí mồi bắt cặp gây tín hiệu không rõ ràng. Các trình tự nucleotid vùng này sẽ được hiệu chỉnh bằng các trình tự bắt cặp bổ sung tương ứng trên đoạn nucleotid đã được giải trình tự bằng mồi ngược lại. Đoạn trình tự sau hoàn thiện được kiểm tra mức độ tương đồng bằng chương trình BLAST. Kết quả, trình tự thu nhận được có độ tương đồng cao với trình tự gen EBNA2-A và EBNA2-B của human herpes virus 4 (HQ827839). Như vậy, quy trình phản ứng Nested-PCR định typ EBV đã được nhóm nghiên cứu chuẩn hoá và hoàn thiện thành công.
Tỷ lệ nhiễm EBV trong quần thể trên thế giới là khoảng 97% (theo De The G. và cộng sự). Tại Đài Loan – một nước khá gần gũi về vị trí địa lý và văn hoá, tỷ lệ lây nhiễm EBV là 100%[7]. Tại Việt Nam, xác định tỷ lệ nhiễm EBV bằng kỹ thuật huyết thanh học cho kết quả là 95,7% [8]. Trong nghiên cứu của chúng tôi, thông qua mẫu nước bọt, tỷ lệ nhiễm EBV chỉ 50,38%. Sự khác biệt này là do phương pháp phát hiện EBV bằng Nested-PCR trên mẫu nước bọt chỉ phát hiện sự có mặt của EBV tại thời điểm lấy mẫu, trong khi phương pháp huyết thanh học có thể xác định được cả những đối tượng đã từng nhiễm EBV mà tại thời điểm lấy mẫu không còn tồn tại EBV trong cơ thể.
Về typ EBV lây nhiễm, trong hầu hết các quần thể trên thế giới, EBV typ 1 là chủng lây nhiễm chủ yếu, ngoại trừ quần thể người Châu Phi với tỷ lệ nhiễm EBV typ 1 và typ 2 là gần như ngang nhau. Tại Việt Nam, Trần Thị Chính và cộng sự đã tiến hành xác định tỷ lệ nhiễm các chủng EBV trên 32 mẫu máu người khoẻ mạnh, kết quả cho thấy EBV typ 1 là chủng lây nhiễm chính (66,67%) trong khi EBV typ 2 chỉ 33,33%[9]. Kết quả này cũng tương đồng với nghiên cứu của nhóm với tỷ lệ EBV typ 1 chiếm ưu thế (36,64%), trong khi EBV typ 2 chỉ 6,87%.
Tỷ lệ nhiễm EBV ở nhóm đối tượng nam giới khoẻ mạnh là 46,15%; tương đương với tỷ lệ ở nhóm nữ giới khoẻ mạnh (48%). Về tỷ lệ nhiễm từng chủng, có sự tương đồng về tỷ lệ nhiễm giữa hai nhóm: tỷ lệ nhiễm EBV typ 1 ở nhóm nam và nữ lần lượt là 35,16% và 32%; tương tự với EBV typ 2 là 6,59% và 8% ở nhóm nam giới và nữ giới khoẻ mạnh. Tỷ lệ đối tượng mắc cả 2 typ EBV có sự chênh lệch khi ở nhóm nam chỉ có 4,39% còn nhóm nữ lại cao hơn (10%). Tóm lại, không có sự khác biệt lớn về tỷ lệ nhiễm EBV và tỷ lệ nhiễm từng chủng trong mẫu nước bọt giữa hai giới tính ở thanh niên khoẻ mạnh trong độ tuổi 18-25.
V. KẾT LUẬN
- Đã chuẩn hoá và hoàn thiện quy trình định typ EBV trong mẫu nước bọt bằng kỹ thuật Nested-PCR.
- Mẫu nước bọt thanh niên khoẻ mạnh (18-25 tuổi) có tỷ lệ nhiễm EBV là 50,38% trong đó: tỷ lệ nhiễm EBV typ 1 là 36,64%; tỷ lệ nhiễm EBV typ 2 là 7,63% và tỷ lệ nhiễm cả 2 typ là 6,87%.
- Không có sự khác biệt lớn về tỷ lệ nhiễm EBV và tỷ lệ từng chủng nhiễm trong mẫu nước bọt giữa hai giới tính ở thanh niên khoẻ mạnh (18-25 tuổi).
TÀI LIỆU THAM KHẢO
- CDC – National Center for Infectious Diseases. (2020). About 90% of adults have antibodies that show that they have a current or past EBV infection.
- Wei W., Huang Z., Li S., et al. (2014). Pretreatment Epstein-Barr virus DNA load and cumulative cisplatin dose intensity affect long-term outcome of nasopharyngeal carcinoma treated with concurrent chemotherapy: experience of an institute in an endemic area. Oncol Res Treat, 37(3), 88–95.49.
- Reusch J.A., Nawandar D.M., Wright K.L., et al. (2015). Cellular differentiation regulator BLIMP1 induces Epstein-Barr virus lytic reactivation in epithelial and B cells by activating transcription from both the R and Z promoters. J Virol, 89(3), 1731–1743.
- Cancer Research UK. (2014). Developing a vaccine for the Epstein–Barr Virus could prevent up to 200,000 cancers globally say experts.
- Khan G, Fitzmaurice C, Naghavi M, Ahmed LA. (2020). Global and regional incidence, mortality and disability-adjusted life-years for Epstein-Barr virus-attributable malignancies, 1990-2017. BMJ Open. 10 (8): e037505. doi:10.1136/bmjopen-2020-037505.
- Knipe D. M., Howley P. M.Rickinson, A. B. and Kieff, E. (2001). Epstein–Barr virus. In (eds.), Fields Virology Lippincott Williams and Wilkins; Philadelphia.
- Kee Ching G., Chen Yi Hsu et al. (1994). Prevalence of Taiwan variant of Epstein-Barr virus in throat washings from patients with head and neck tumors in Taiwan. J. of Clinical Microbiology, Vol 32, No.1, p28-31.
- Hu L.F. (1996). Nasopharyngeal carcinoma and EBV. PhD thesis MTC.
- T.T et al. (2007). Định týp Epstein-Barr Virus trong mô sinh thiết bệnh nhân ung thư vòm mũi họng bằng kỹ thuật PCR.
( Nguồn: Số 518, tháng 9/2022, Tạp chí Y Học Việt Nam, trang 215-222, link full tạp chí: ![]() )
)
