Vũ Thảo Hằng2, Đặng Tiến Trường2, Nguyễn Duy Bắc2, Nguyễn Xuân Kiên2
1Bệnh viện Quân y 103
2Học viện Quân y
Chịu trách nhiệm chính: Nguyễn Xuân Kiên
Email: xuankiễn@yahoo.com
Ngày nhận bài: 29/7/2022
Ngày phản biện khoa học: 16/08/2022
Ngày duyệt bài: 05/09/2022
I. ĐẶT VẤN ĐỀ
Trong máu của thai phụ, ngoài cfDNA của người phụ nữ còn có một lượng nhỏ DNA tự do của thai nhi được gọi là cell-free fetal DNA (cffDNA) lưu hình trong hệ tuần huần của thai phụ [21]. cffDNA có nguồn gốc chủ yếu từ những tế bào gai nhau chết theo chu trình của tế bào [3, 25]; có thể phát hiện sớm nhất vào tuần thứ 4 của thai kỳ [13] và bị đào thải hoàn toàn sau khi sinh trong vòng 24 đến 48 giờ [16, 27]. Lượng cffDNA chỉ chiếm 0,1 – 46,1% trong tổng số DNA tự do trong máu của người mẹ [9] và hàm lượng cffDNA sẽ tăng theo các giai đoạn phát triển của thai nhi [15]. Không giống với DNA của tế bào, DNA phôi thai tự do chủ yếu gồm các đoạn DNA nhỏ, có kích thước dưới 193 bp và ngắn hơn DNA tự do có nguồn gốc từ mẹ [5]. DNA phôi thai tự do với ưu điểm xuất hiện sớm, tồn tại trong suốt thai kỳ và không tìm thấy trong máu mẹ sau khi sinh. Vì vậy, cffDNA được coi là dấu ấn sinh học đầy hứa hẹn trong chẩn đoán trước sinh không xâm lấn từ giai đoạn sớm của thai kỳ.
Xét nghiệm sàng lọc trước sinh không xâm lấn (NIPT) phân tích DNA phôi thai tự do (cffDNA) trong máu ngoại vi của người mẹ giúp phát hiện sớm các hội chứng liên quan đến bất thường về số lượng NST ở thai nhi với độ chính xác cao, quy trình thu mẫu đơn giản, an toàn cho mẹ và thai nhi. Nhờ kỹ thuật giải trình tự thế hệ mới (NGS), kết hợp với phân tích tin sinh giúp phân tích các cffDNA, việc sàng lọc và đánh giá khả năng thai nhi mắc các rối loạn liên quan đến các bất thường số lượng nhiễm sắc thể với hàm lượng cffDNA của thai nhi rất thấp. NIPT sàng lọc và phát hiện di tật thai nhi từ rất sớm giúp bác sỹ đưa ra các phương pháp chẩn đoán cũng như can thiệp kịp thời, tối ưu cho mẹ và thai nhi thay vì phải thực hiện các phương pháp xâm lấn khác ảnh hưởng đến sức khỏe của thai phụ và thai nhi…
Để kết quả NIPT đáng tin cậy, tỷ lệ phần trăm cffDNA có nguồn gốc từ thai nhi và cfDNAtrong huyết tương của người mẹ,được gọi là tỷ lệ DNA phôi thai thai tự do ( fetal faction- ff) phải đủ lớn để tránh kết quả âm tính giả hoặc xét nghiệm thất bại dẫn đến phải thu mẫu, xét nghiệm lại. Hầu hết các kỹ thuật NIPT yêu cầu tỷ lệ này trên 4% [4] và thường được thực hiện sau tuần thứ 10 của thai kỳ. Tuy nhiên, các cải tiến kỹ thuật gần đây giúp làm giàu DNA phôi thai tự do trong mẫu giải trình tự giúp cải thiện độ độ nhạy của NIPT nên có tiềm năng giúp thực hiện kỹ thuật này ở tuổi thai sớm hơn [20]..
Các nghiên cứu đã sử dụng kỹ thuật PCR, nested PCR, RFLP, Realtime PCR, để phát hiện DNA phôi thai tự do lưu hành trong tuần hoàn mẹ. Trên thế giới đã có nhiều nghiên cứu đã áp dụng kỹ thuật Realtime PCR thực hiện gen SRY để định lượng DNA phôi thai tự do từ tuần thứ 5 của thai kỳ và gen HBB như marker đại diện cho DNA tổng số trong huyết tương thai phụ [6, 11, 15]. Nhiều nghiên cứu sử dụng nhiều thuật toán khác nhau để tính toán FF (SeqFF, FetalQuant, DEFRAG, DANSRTM, …) chỉ ra FF tăng dần theo tuổi thai tuổi thai sớm (6-15 tuần tuổi) [10, 12, 14, 17-19, 22-24, 26].Tuy nhiên, kết quả khảo sát nồng độ cffDNA trước 10 tuần còn hạn chế và nhiều mâu thuẫn. Khảo sát tỷ lệ DNA phôi thai tự do ở giai đoạn trước 10 tuần là cơ sở cho việc triển khai NIPT ở tuổi thai sớm hơn.
II. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Đối tượng
50 thai phụ, được theo dõi và khẳng định mang thai nam có tuổi thai từ tuần thứ 6 đến tuần thứ 15 của thai kỳ tham gia chương trình sàng lọc bệnh di truyền liên kết nhiễm sắc thể X và sàng lọc lệch bội nhiễm sắc thể không xâm lấn tại Học viện Quân y và Bệnh viện Phụ sản Hà Nội.
2.2. Phương pháp
Tách huyết tương
Mẫu máu được ly tâm 2 lần để thu huyết tương. Bảo quản huyết tương thu được ở -80◦C cho đến khi sử dụng.
Tách cfDNA
cfDNA được tách từ 200µl mẫu huyết tương bằng bộ kit QIAamp® DNA Mini Kit (Qiagen, Hilden, Germany) theo hướng dẫn của nhà sản xuất. DNA được bảo quản ở -80◦C cho đến khi sử sụng.
Định lượng DNA tự do bằng kỹ thuật Realtime PCR
Mẫu DNA huyết tương được sử dụng để thực hiện kỹ thuật Realtime PCR định lượng gen SRY và gen HBB (là marker đặc hiệu cho DNA tự do tổng số trong huyết tương.
Trình tự mồi và probe của gen SRY: SRY-F: 5’-TCCTCAAAAGAAACCGTGCAT-3’; SRY-R: 5’-AGATTAATGGTTGCTAAGGACTGGAT-3’; SRY-P: 5’- (FAM) CACCAGCAGTAACTCCCCACAACCTCTTT (TAMRA)-3’. Trình tự mồi và probe của gen HBB: HBB-F: 5’-GTGCACCTGACTCCTGAGGAGA-3’; HBB-R: 5’-CCTTGATACAACCTGCCCAG-3’. HBB-P: 5’-(FAM) AAGGTGAACGTGGATGAAGTTGGTGG (TAMRA)-3’ [9].
Thực hiện phản ứng PCR đơn mồi (từng cặp primer và probe riêng lẻ) để định lượng DNA thai nhi tự do bằng Realtime PCR. Thể tích phản ứng là 25µl,s gồm: Quantitect probe PCR mastermix 1X; 2,5µM primer mỗi loại; 1,25µM probe; DNA template, mẫu chuẩn đã được pha loãng ở các nồng độ từ 106 đến 102 bản sao/ml hoặc nước làm đối chứng âm vừa đủ. Điều kiện của phản ứng Realtime PCR được sử dụng theo khuyến cáo của Qiagen. Chu trình nhiệt của phản ứng Realtime PCR gồm: biến tính ở 95oC trong 15 phút; 50 chu kỳ: 94oC trong 15 giây, 60oC trong 1 phút.
Đường chuẩn được xây dựng sử dụng dung dịch DNA đã biết trước nồng độ được tổng hợp bởi Phusa Bio Chemistry Co. Ltd,. Tiến hành tính toán nồng độ mẫu chuẩn theo định luật Avogadro, pha loãng mẫu chuẩn theo các nồng độ từ 106 đến 102 bản sao/ml.
Nồng độ của gen SRY và gen HBB được biểu diễn theo đơn vị bản sao/ml của huyết tương.
Tính toán nồng độ DNA phôi thai tự do thông qua số bản sao của SRY (CSRY) và nồng độ DNA tự do tổng số thông qua số bản sao nằm trên gen HBB (CHBB). Xác định chỉ số ff =cffDNA/cfDNA×100%.
III. KẾT QUẢ VÀ BÀN LUẬN
3.1. Kết quả đường chuẩn của kỹ thuật Realtime PCR để định lượng DNA tự do trong huyết tương thai phụ
Đường chuẩn được xây dựng từ các mẫu chuẩn đã được pha loãng liên tiếp, được tiến hành kỹ thuật Realtime PCR bằng máy Realtime PCR Rotor-Gene-Q (QIAGEN). Kết quả thu được được trình bày ở hình 1:
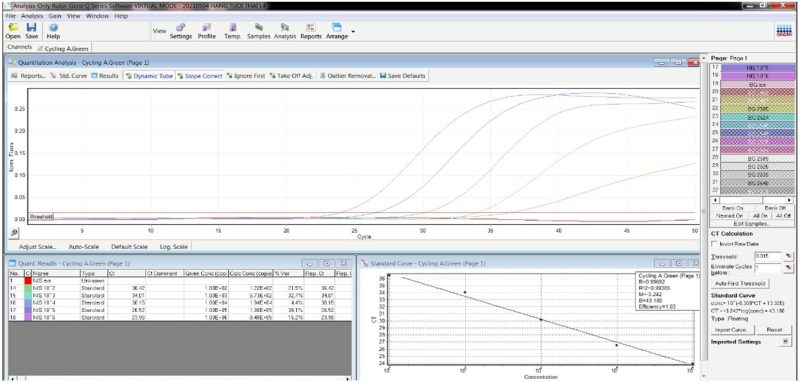
A. Gen SRY
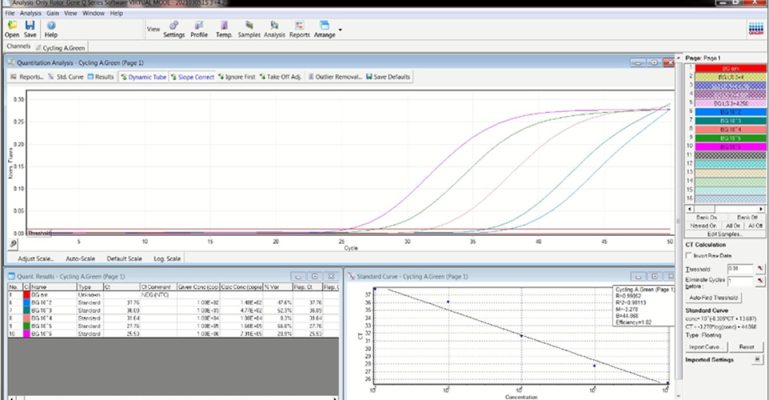
B. Gen HBB
Hình 2. Hình ảnh đường chuẩn của phản ứng Realtime PCR
Một phản ứng qPCR tối ưu cần có R2>0.98 và hiệu quả khuếch đại cao 90-105%; hơn nữa [11]. Các mẫu chuẩn được pha loãng từ 106-102 copy/ml. Kết quả phân tích cho thấy đường chuẩn đảm bảo yêu cầu với R2=0.994, E=103% với gen SRY (Hình 1A) và R2=0.981, E=102% với gen HBB (Hình 1B). Đường chuẩn được thực hiện phản ứng cùng với các mẫu cần định lượng, các lần thực hiện đều cho tín hiệu tốt với R2>0.98 và E = 90-105% để đảm bảo phân tích có độ lặp lại tốt.
3.2. Định lượng nồng độ DNA phôi thai tự do trong huyết tương thai phụ
Phản ứng Realtime PCR sử dụng cặp mồi của gen SRY để định lượng số bản sao DNA phôi thai tự do có trong mẫu.
Kết quả cho thấy, gen SRY đã phát hiện ở 37 trên 50 mẫu thai phụ mang thai nam.19 mẫu không đạt với cặp mồi gen SRY sẽ loại khỏi kết quả nghiên cứu. Kết quả nồng độ DNA phôi thai tự do của 31 mẫu đạt được tình bày trong bảng 1.
Bảng 3. Nồng độ DNA phôi thai tự do trung bình ở các tuần thai
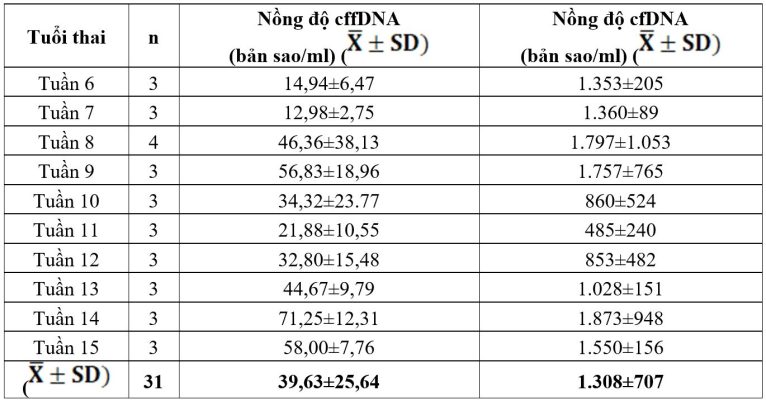
Nồng độ DNA phôi thai tự do trong huyết tương thai phụ ở các nhóm tuổi thai khác nhau là 39,63±25,64 (bản sao/ml) với khoảng giá trị 9,18-107,25 (bản sao/ml).
Nồng độ cffDNA ở tuần thứ 6 là 14,94 (bản sao/ml) và tuần thứ 15 là 58 (bản sao/ml). Nồng độ cffDNA phụ thấp nhất ở tuần thứ 7 là 12,98 bản sao/ml và cao nhất ở tuần thứ 14 là 71,25 bản sao/ml; nồng độ này có xu hướng tăng dần theo tuổi thai từ 6 đến 15 tuần. Kết quả của nghiên cứu này phù hợp với nghiên cứu của Edna D’Souza và cộng sự (2012)[2, 8]. Nồng độ cffDNA từ tuần 11-17 là 25,4 bản sao/ml (Lo và cs, 1998). [15]. Bên cạnh đó, báo cáo khác tại Việt Nam cho thấy nồng độ cffDNA trung bình là 574,8 bản sao/ml ở thai phụ từ 12-14 tuần tuổi [1]. Kết quả ở tuổi thai từ 6,7,8,9,10,11,12 tuần tuổi có nồng độ cffDNA tăng dần [8].
Nồng độ DNA tự do huyết tương thai phụ ở tất cả các nhóm là 1.308±707 (bản sao/ml). Nồng độ DNA tự do trong huyết tương của thai phụ trung bình ở các tuần thai từ 6 đến 15 tuần cho thấy, nồng độ ở tuần thứ 6 là 1.353 (bản sao/ml) và tuần thứ 15 là 1.550 (bản sao/ml). Nồng độ DNA tự do trong huyết tương thai phụ thấp nhất ở tuần thứ 11 là 485 (bản sao/ml), cao nhất ở tuần thứ 14 là 1.873 (bản sao/ml); nồng độ này không có mối liên hệ với tuổi thai ở thai phụ từ 6 đến 15 tuần.
3.2. Mối tương quan giữa FF và tuổi thai
Kết quả FF của 31 mẫu nghiên cứu được tình bày trong bảng 2.
Bảng 4. Giá trị FF ở các thai phụ ở tuần thai từ 6 đến 15 tuần
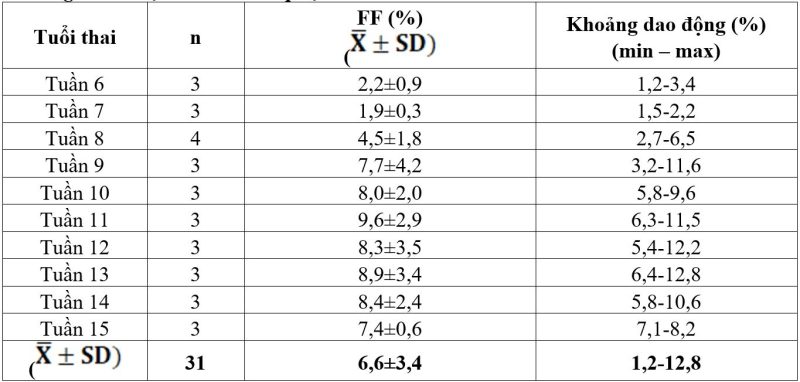
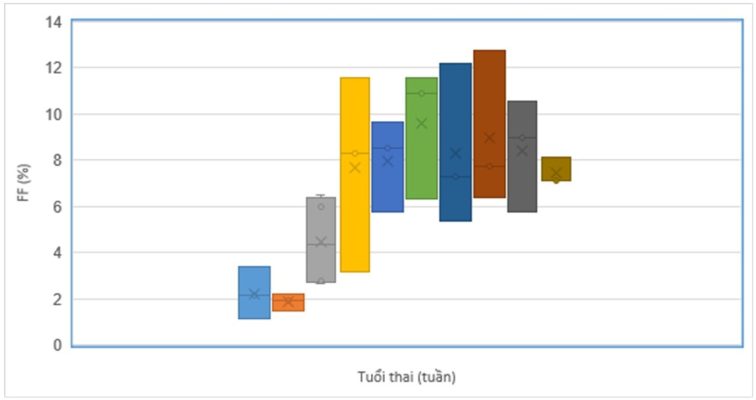
Hình 3. Mối quan hệ giữa tuổi thai và FF
Chú thích:

Kết quả Bảng 2 và Hình 2 cho thấy FF thấp nhất ở tuần thai thứ 7 là 1,9% (màu cam); cao nhất ở tuần thai thứ 11 là 9,6% (màu xanh lá). Phân tích hồi quy tuyến tính của biến độc lập cho thấy mối tương quan thuận giữa FF với tuổi thai từ 6-15 tuần tương đối chặt và có ý nghĩa thống kê (R2=0,38, p<0,05). FF ở tuần thứ 6 là 2,2% và tuần thứ 15 là 7,4%; tỷ lệ phần trăm thay đổi theo xu hướng tăng nhẹ theo tuổi thai từ 6 đến 15 tuần.
Phân tích theo từng nhóm cho thấy FF ở tuần thai thứ 8 có FF cao hơn ở tuổi thai 7 tuần, với p<0,05. FF tiếp tục tăng ở tuần thai thứ 9, tuần thứ 11. Ở nhóm tuần 7, tuần 12, tuần 15, FF có giảm nhẹ nhưng không có ý nghĩa thống kê. Kết quả FF ở một số tuần thai chưa phù hợp với xu hướng chung có thể ảnh hưởng bởi sự sai khác của một số nhóm thai phụ có tỷ lệ FF ở tuổi thai này. Điều này đã được báo cáo trong một số nghiên cứu trước đây [2]. Kết quả nghiên cứu FF và tuổi thai có mối tương quan, và FF xu hướng tăng theo tuổi thai từ 6-15 tuần. Kết quả nghiên cứu này phù hợp với các kết quả nghiên cứu trước đây về mối quan hệ giữa FF và tuổi thai [10, 12, 14, 17-19, 22-24, 26]. Cụ thể, ở tuổi thai 10 tuần – 10 tuần 6 ngày, FF trung bình 10,2%; từ 10-21 tuần, FF tăng 0,1% mỗi tuần, và bắt đầu từ khi thai được 21 tuần, FF tăng với tốc độ 1% mỗi tuần. Tuy nhiên, 2% số thai phụ ở giai đoạn này có FF dưới 4% [26]. Sarah L. Kinnings và cộng sự (2015) báo cáo tuổi thai tương quan thuận với FF (Spearman’s p=-,2141), từ 10-12,5 tuần tuổi thai, FF tăng với tỷ lệ 0,44% mỗi tuần, tăng khoảng 0,083% mỗi tuần từ tuần thai thứ 12,5-20. FF tăng cao hơn đáng kể từ tuần thai 20, FF tăng tối đa 0,821% mỗi tuần, FF trung bình ở tuần thai thứ 30 trở đi (≈20%) nhiều hơn gấp đôi với FF trung bình ở tuần thai thứ 20 (≈9%) [14]. Caroline Borregaard Miltoft và cộng sự (2019), FF trung bình là 9,3% (7,4-11,4%) ở tuần thai 11,3-13; FF tăng 1,2% mỗi tuần trước tuần thứ 10 và 0,6%/tuần từ 10-12 tuần, sau 12 tuần FF tăng 0,4%/ tuần (FF tăng không có ý nghĩa thống kê) [17]. Theo Eugene Pergament và cộng sự (2015), FF và tuổi thai có tỷ lệ thuận, FF tăng trung bình 2,6%/tuần từ thai phụ có tuổi thai từ tuần thứ 8-10, 0,2%/ tuần từ tuần thứ 10-20, và 0,7% mỗi tuần sau 20 tuần tuổi thai [19]. Matthew S. Hestand (2018) và cộng sự, Nobuhiro Suzumori và cộng sự (2016) đã báo cáo rằng không có khác biệt có ý nghĩa thống kê giữa FF và tuổi thai trong khoảng từ tuần thai 10-21 [10, 24].
Tuy nhiên, một số nghiên cứu cũng có kết quả trái ngược. Mary E. Norton và cộng sự (2012) báo cáo rằng đối với tuổi thai từ 10-12 tuần, FF không thay đổi đáng kể [18]. Irena Hudecova (2014) cho rằng FF tăng có ý nghĩa thống kê giữa FF và tuổi thai của thai phụ có tuổi thai từ 11-14 tuần, tuy nhiên mối tương quan này rất yếu (R2=0,026, p=0,028) [12]. Theo Y Song và cộng sự (2014) đã báo cáo từ thai phụ có tuần thai từ 8-12 tuần của thai kỳ, tổng thể FF có xu hướng tăng nhẹ nhưng không có sự khác biệt có ý nghĩa thống kế giữa 8,9,10,12 tuần [23]. Trong thời kỳ đầu đầu của thai kỳ (từ tuần thai thứ 8-12), theo Xiaolin Shi và cộng sự (2014), FF trung bình 7,6%; trong khoảng từ 51-84 ngày thai, FF có xu hướng tăng rất ít theo ngày. Trong tam cá nguyệt thứ 2 (105-120 ngày thai), FF trung bình là 10,47% (3,93-31,45%) và ở giai đoạn này FF tăng rất ít và không có ý nghĩa thống kê [22]. Kết quả về nồng độ cffDNA phôi thai tự do trong huyết tương thai phụ ở nghiên cứu khác nhau giữa các nghiên cứu. Điều này có thể do phương thức thu huyết tương, kit tách DNA, hiệu suất của phản ứng real time PCR và các yếu tố khác liên quan tới đặc điểm của từng nhóm thai phụ, thai nhi [4, 7, 12, 14, 18].
Kết quả nghiên cứu cho thấy, FF ở tuần thai thứ 8 là 4,5% cao hơn giá trị FF thấp nhất để thực hiện kỹ thuật NIPT. Điều này cho thấy có thể thực hiện phân tích NIPT từ tuần thứ 8 của thai kỳ, sớm hơn 2 tuần so với hiện nay. Điều này có nhiều ý nghĩa trong sàng lọc và chuẩn đoán trước sinh. Hơn nữa, những cải tiến của kỹ thuật NIPT trong thờitới có càng khẳng địch cho việc xét nghiệm NIPT ở tuổi thai sớm hơn, độ chính xác cao hơn [20].
V. KẾT LUẬN
Nồng độ DNA phôi thai tự do trong huyết tương ở thai phụ từ 6 đến 15 tuần có xu hướng tăng dần theo tuổi thai. Kết quả nghiên cứu cho thấy FF ở tuần thứ 8 khoảng 4,5% đạt ngưỡng khuyến cáo áp dụng xét nghiệm sàng lọc trước sinh không xâm lấn ở tuần thứ 8 để sàng lọc một số hội chứng di truyền ở thai nhi.
TÀI LIỆU THAM KHẢO
- Nguyễn Thị Phương Lan (2019), “Nghiên cứu DNA phôi thai tự do trong huyết tương thai phụ bằng kỹ thuật Realtime PCR nhằm dự báo sớm tiền sản giật”, Luận án Tiến sĩ, Đại học Y Hà Nội.
- Triệu Tiến Sang, Trần Văn Khoa, and Đinh Đoàn Long (2014), “Khảo sát và định lượng ADN phôi thai tự do trong huyết tương của mẹ ở các tuần tuổi thai từ 6 tuần đến 22 tuần bằng các phương pháp Reatime PCR”, Y học Việt Nam pp. 138-146.
- Alberry, M, et al. (2007), “Free fetal DNA in maternal plasma in anembryonic pregnancies: confirmation that the origin is the trophoblast”, Prenatal Diagnosis: Published in Affiliation With the International Society for Prenatal Diagnosis. 27(5), pp. 415-418.
- Ashoor, G, et al. (2013), “Fetal fraction in maternal plasma cell‐free DNA at 11–13 weeks’ gestation: relation to maternal and fetal characteristics”, Ultrasound in Obstetrics & Gynecology. 41(1), pp. 26-32.
- Chan, KC Allen, et al. (2004), “Size distributions of maternal and fetal DNA in maternal plasma”, Clinical chemistry. 50(1), pp. 88-92.
- Costa, Jean‐Marc, et al. (2001), “First‐trimester fetal sex determination in maternal serum using real‐time PCR”, Prenatal Diagnosis: Published in Affiliation With the International Society for Prenatal Diagnosis. 21(12), pp. 1070-1074.
- Curnow, Kirsten J, et al. (2014), “Clinical experience and follow-up with large scale single-nucleotide polymorphism–based noninvasive prenatal aneuploidy testing”, American journal of obstetrics and gynecology. 211(5), pp. 527. e1-527. e17.
- D’Souza, Edna, et al. (2012), “SRY sequence in maternal plasma: Implications for non-invasive prenatal diagnosis: First report from India”, Indian journal of human genetics. 18(1), p. 87.
- Davalieva, Katarina, et al. (2006), “Non-invasive fetal sex determination using real-time PCR”, The Journal of Maternal-Fetal & Neonatal Medicine. 19(6), pp. 337-342.
- Hestand, Matthew S, et al. (2019), “Fetal fraction evaluation in non-invasive prenatal screening (NIPS)”, European Journal of Human Genetics. 27(2), pp. 198-202.
- Honda, Hiroshi, et al. (2002), “Fetal gender determination in early pregnancy through qualitative and quantitative analysis of fetal DNA in maternal serum”, Human genetics. 110(1), pp. 75-79.
- Hudecova, Irena, et al. (2014), “Maternal plasma fetal DNA fractions in pregnancies with low and high risks for fetal chromosomal aneuploidies”, PloS one. 9(2), p. e88484.
- Illanes, S, et al. (2007), “Early detection of cell-free fetal DNA in maternal plasma”, Early human development. 83(9), pp. 563-566.
- Kinnings, Sarah L, et al. (2015), “Factors affecting levels of circulating cell‐free fetal DNA in maternal plasma and their implications for noninvasive prenatal testing”, Prenatal Diagnosis. 35(8), pp. 816-822.
- Lo, YM Dennis, et al. (1998), “Quantitative analysis of fetal DNA in maternal plasma and serum: implications for noninvasive prenatal diagnosis”, The American Journal of Human Genetics. 62(4), pp. 768-775.
- Lo, YM Dennis, et al. (1999), “Rapid clearance of fetal DNA from maternal plasma”, The American Journal of Human Genetics. 64(1), pp. 218-224.
- Miltoft, Caroline Borregaard, et al. (2020), “Cell-free fetal DNA in the early and late first trimester”, Fetal diagnosis and therapy. 47(3), pp. 228-236.
- Norton, Mary E, et al. (2012), “Non-Invasive Chromosomal Evaluation (NICE) Study: results of a multicenter prospective cohort study for detection of fetal trisomy 21 and trisomy 18”, American journal of obstetrics and gynecology. 207(2), pp. 137. e1-137. e8.
- Pergament, Eugene, et al. (2014), “Single-nucleotide polymorphism–based noninvasive prenatal screening in a high-risk and low-risk cohort”, Obstetrics and gynecology. 124(2 0 1), p. 210.
- Qiao, Longwei, et al. (2019), “Sequencing of short cfDNA fragments in NIPT improves fetal fraction with higher maternal BMI and early gestational age”, American journal of translational research. 11(7), p. 4450.
- Sekizawa, Akihiko, et al. (2000), “Apoptosis in fetal nucleated erythrocytes circulating in maternal blood”, Prenatal diagnosis. 20(11), pp. 886-889.
- Shi, Xiaolin, et al. (2015), “Feasibility of noninvasive prenatal testing for common fetal aneuploidies in an early gestational window”, Clinica Chimica Acta. 439, pp. 24-28.
- Song, Y, et al. (2015), “Non‐invasive prenatal testing for fetal aneuploidies in the first trimester of pregnancy”, Ultrasound in Obstetrics & Gynecology. 45(1), pp. 55-60.
- Suzumori, Nobuhiro, et al. (2016), “Fetal cell-free DNA fraction in maternal plasma is affected by fetal trisomy”, Journal of human genetics. 61(7), pp. 647-652.
- Tjoa, May Lee, et al. (2006), “Trophoblastic oxidative stress and the release of cell-free feto-placental DNA”, The American journal of pathology. 169(2), pp. 400-404.
- Wang, Eric, et al. (2013), “Gestational age and maternal weight effects on fetal cell‐free DNA in maternal plasma”, Prenatal diagnosis. 33(7), pp. 662-666.
- Yu, Stephanie CY, et al. (2013), “High-resolution profiling of fetal DNA clearance from maternal plasma by massively parallel sequencing”, Clinical chemistry. 59(8), pp. 1228-1237.
- Zhou, Yi, et al. (2015), “Effects of maternal and fetal characteristics on cell-free fetal DNA fraction in maternal plasma”, Reproductive Sciences. 22(11), pp. 1429-1435.
( Nguồn: Số 518, tháng 9/2022, Tạp chí Y Học Việt Nam, trang 228-236. link full tạp chí: ![]() )
)
